Valentin Chioncel,
1,
& ast;
Catalina Liliana Andrei,
1,
& ast;
Radu Brezeanu,
1,
& ast;
Crina Sinescu,
1,
& ast;
Anamaria Avram,
1,
& ast;
Alin Laurentiu Tatu
2,
& ast;
1
Departamento de Patologia Cardio-Torácica, Faculdade de Medicina, Universidade de Medicina e Farmácia “Carol Davila”, Bucareste, 050474, Romênia;
2
Unidade de Pesquisa Médica e Farmacêutica / Plataforma Integrada de Pesquisa Competitiva e Interdisciplinar “Dun & abreve; rea de Jos”, ReForm-UDJG, Centro de Pesquisa na Área de Ciências Médicas e Farmacêuticas, Faculdade de Medicina e Farmácia, Departamento de Clínica Médica, “Dun & abreve; rea de Jos ”University of Galati, Galati, 800010, Romania & ast; Esses autores contribuíram igualmente para este trabalhoCorrespondência: Valentin ChioncelDepartment of Cardio-Thoracic Pathology, Faculty of Medicine,“ Carol Davila ”University of Medicine and Pharmacy, Bucharest, 050474, RomaniaEmail
[email protegido]
Resumo:
O desenvolvimento de stents coronários representou uma revolução no tratamento das doenças cardíacas coronárias. Além de suas muitas vantagens, os stents também têm suas limitações e complicações. As reações alérgicas aos stents coronários são mais comuns do que se reconhece. Esses pacientes com stent são expostos a substâncias estranhas inseridas em contato direto com a íntima coronariana. A hipersensibilidade aos componentes do stent e aos medicamentos prescritos após a inserção do stent, juntamente com qualquer exposição ambiental, parecem contribuir para essas reações adversas. Os pacientes podem apresentar-se ao hospital com uma ampla gama de sintomas e complicações múltiplas, sendo as mais importantes a reestenose do stent e a trombose do stent. Embora não sejam muito comuns (e nem sempre fáceis de identificar), as reações alérgicas após stents coronários ou periféricos devem ser levadas em consideração. A seleção cuidadosa dos pacientes (para implante eletivo de stent) em função da propensão a alergias, embora difícil de realizar, representa um fator chave na redução do número dessas complicações.
Palavras-chave:
stents, alergia, reestenose, trombose, síndrome de Kounis
Introdução
As doenças cardiovasculares são distúrbios que envolvem o coração ou os vasos sanguíneos e são consideradas a principal causa de morbidade e mortalidade em todo o mundo.
1
Desde as primeiras dilatações com balão em 1977, a angioplastia coronária se tornou a principal terapia para doenças cardíacas coronárias.
2
As principais desvantagens decorrentes da angioplastia com balão - recuo elástico do vaso e dissecções coronárias - foram diminuídas com o implante de stent. O primeiro implante de stent coronário em um ser humano em 1984 representou um grande avanço no tratamento desses pacientes.
Mais de 2 milhões de stents estão sendo implantados anualmente em todo o mundo, a maioria deles farmacologicamente ativos.
3
Embora este seja um passo revolucionário no tratamento de pacientes coronarianos, os stents - assim como qualquer outra terapia - também estão sujeitos a complicações ou efeitos colaterais.
Durante as intervenções coronárias percutâneas (ICP), um stent coronário expansível é colocado dentro da artéria culpada e a lesão arterial é uma consequência inevitável de todos os procedimentos intervencionistas; esta lesão inicia uma cascata de eventos celulares e moleculares.
Os stents são geralmente de metal, sendo o níquel, o cobalto e o cromo os mais comuns. As reações alérgicas cutâneas e extracutâneas, juntamente com a hipersensibilidade do tipo retardado devido à exposição crônica ao metal são bem conhecidas e documentadas na literatura (trombose de stent, reestenose de instent, inflamação, dor).
Apesar das repetidas tentativas e pesquisas para entender melhor essa patologia, a associação entre a sensibilidade ao metal e a resposta alérgica aos stents intravasculares ainda precisa ser descoberta.
Esta revisão pode fornecer uma atualização sobre as informações atuais neste domínio e pode ser muito útil para médicos que encontram e gerenciam pacientes com essas condições.
Questões principais
As principais complicações do implante de stent são representadas pela reestenose e trombose do stent.
4
,
5
A reestenose coronariana é consequência da hiperplasia intimal em resposta à lesão por balão / stent. Esse foi um grande desafio que foi bastante reduzido após o surgimento dos stents impregnados com substâncias ativas, os chamados stents farmacológicos (SF). Os primeiros estudos publicados com DES (RAVEL, SIRIUS) mostraram uma taxa muito menor de reestenose em comparação com os stents de metal puro.
6
,
7
Posteriormente, inúmeras pesquisas confirmaram as vantagens óbvias do DES.
8-10
Atualmente, a incidência de reestenose de instantes em todos os procedimentos coronários invasivos é em torno de 10–15% e o principal tratamento geralmente é a inserção de outro stent ou Angioplastia com Balão de Eluição de Medicamentos (DEBA).
11
A trombose do stent é uma complicação rara, mas às vezes crítica da ICP, que pode causar infarto do miocárdio ou morte.
12
A incidência de trombose de stent varia entre 0,5% e 2% e pode ocorrer apesar do progresso recente na terapia e técnica antiplaquetária.
13-15
Algumas vezes foi levantado a questão de saber se essas complicações principais (reestenose e trombose do stent) podem estar relacionadas a alergias ou hipersensibilidade aos materiais do stent. Portanto, as pesquisas atuais estão focadas na segurança dos stents coronários.
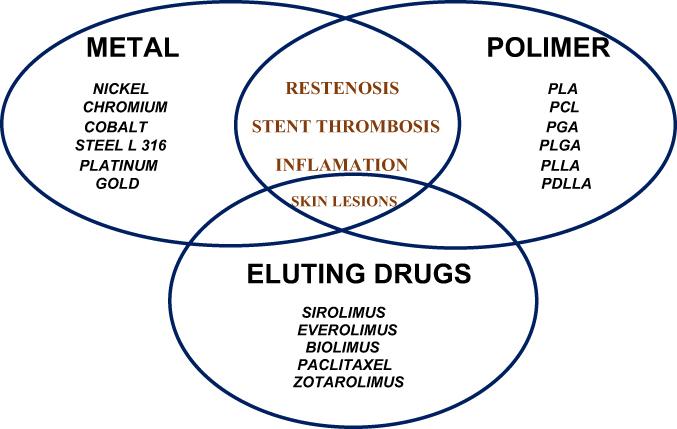
As reações de hipersensibilidade DES representam um desafio crescente e podem ser o resultado de drogas eluídas ou metais intrínsecos e polímeros de stent - ver
figura 1
. Às vezes, a medicação antiplaquetária pode estar envolvida, de modo que a relação de causalidade não é muito fácil de estabelecer.
figura 1
Efeitos colaterais de hipersensibilidade dos stents.
Durante os últimos 30 anos, tem havido uma preocupação crescente na comunidade médica e de pacientes sobre possíveis reações alérgicas (hipersensibilidade) a materiais estranhos implantados no corpo.
Uma das principais questões é se as reações de hipersensibilidade a materiais de stents de artéria intracoronária podem estar associadas à reestenose e trombose de instantes.
Reestenose instantânea
Os stents de metal puro são feitos de aço inoxidável, que é um aço com adição de níquel e cromo, sendo o níquel uma das causas mais comuns de dermatite alérgica de contato. Os DES contêm, além da estrutura metálica, um revestimento polimérico (permanente ou biodegradável) no qual é impresso o fármaco antiproliferativo.
Conceitualmente, qualquer componente do stent pode induzir trombose ou reestenose imunomediada em pacientes hipersensíveis. Casos sobre essa resposta prejudicial de drogas antiproliferativas e revestimentos de polímero de stents farmacológicos foram relatados,
16
mas permanece incerto se os componentes de metal do stent podem induzir falha local do implante quando usados em pacientes com alergia ao metal.
Relatos de casos de alergia ao níquel foram publicados desde 1980, com estimativas de uma incidência geral de 10% na população em geral. Por se pensar que a sensibilização aos piercings é a causa na maioria dos casos, a incidência em mulheres é maior, entre 14% e 20%.
17
A maioria dos casos relatados de alergia ao níquel se manifesta como dermatite de contato comum, mas os pacientes com implantes médicos contendo níquel que desenvolvem alergia ao níquel geralmente apresentam uma resposta sistêmica mais pronunciada, que frequentemente inclui erupção cutânea eczematosa difusa com nenhuma ou baixa resposta aos corticosteroides.
As reações de hipersensibilidade cutânea são mais frequentemente descritas ao níquel, mas os sinais ou sintomas alérgicos também podem ocorrer em outros metais, como cobalto, cromo, molibdênio e ouro.
18
Desde 1995, os stents coronários usados em todo o mundo têm sido projetados usando plataformas de aço inoxidável 316 L, liga de cobalto-cromo ou liga de platina-cromo e, recentemente, cromato de platina (18–20%) e molibdênio (2,7–9,7%).
Após o implante de um stent que contém níquel, o metal é continuamente liberado para a circulação sistêmica, promovendo a expressão da molécula de adesão intercelular-1 (ICAM-1) nas células endoteliais, que desempenha importante papel no recrutamento de células inflamatórias da a corrente sanguínea.
19
Em casos alérgicos, a liberação de íons metálicos após o contato com a pele induz uma reação de hipersensibilidade do tipo IV mediada por linfócitos T específicos para alérgenos, manifestando-se como erupção cutânea pruriginosa com áreas de vesiculação e desencadeando uma resposta imunológica excessiva.
20
,
21
Apesar do grande avanço tecnológico na produção de stents, a reestenose instantânea continua sendo um grande problema clínico e os fatores predisponentes à reestenose ainda são amplamente desconhecidos.
A reestenose geralmente aparece dentro de 3-6 meses após a intervenção, mas também pode ocorrer mais tarde.
22–24
Muitas vezes é definida como revascularização da lesão-alvo e a incidência em stents tradicionais é geralmente relatada entre 10% e 30%.
24
,
25
A alergia de contato a íons metálicos eluídos dos stents de aço inoxidável, principalmente níquel, cromato e molibdênio, tem sido sugerida como um fator que contribui para a reestenose instantânea.
26
A esse respeito, alguns estudos clínicos sugeriram um risco maior de reestenose em pacientes cujo teste de contato foi positivo para alergia a metais após a colocação do stent.
27
,
28
No entanto, os resultados dos estudos são contraditórios e ainda não há uma conclusão firme nesta área.
No início dos anos 2000, apesar dos dados limitados, a Food and Drug Administration alerta contra o implante de stent em pacientes com histórico de alergia a metais e iniciou um projeto de Pesquisa sobre Eventos Adversos de Drogas / Dispositivos e Relatórios (RADAR) que analisa associações potencialmente causais entre agentes terapêuticos e efeitos adversos eventos.
29
Em outubro de 2003, um parecer da FDA descreveu 50 casos de hipersensibilidade após o implante de stent CYPHER
30
com sintomas como erupção cutânea, dispneia, urticária, coceira e febres, mas um mês depois (novembro de 2003), um aviso de acompanhamento indicou que quase todas as reações de hipersensibilidade foram causadas por terapia medicamentosa padrão associada ao implante de stent.
31
Os investigadores do RADAR avaliaram todos os casos disponíveis para a possibilidade de que os componentes do SF possam ser a causa das reações de hipersensibilidade e este foi o primeiro estudo que avaliou as reações do tipo hipersensibilidade que ocorreram após a colocação do SF.
Dentro de 2 semanas após o implante do stent, 85% desses pacientes desenvolveram sintomas, incluindo erupção cutânea (78%), coceira (27%), urticária (23%), febre (13%) e anafilaxia (6%). Os sintomas persistiram> 30 dias em 50% dos pacientes e foram classificados como graves em 95% dos casos, 34% necessitaram de intervenção emergencial e 18% hospitalização.
Em apenas 17 dos 262 casos de casos de hipersensibilidade relatados ao FDA, o próprio stent parece ser a causa mais provável dos sinais de hipersensibilidade.
De acordo com os critérios específicos da OMS (que classificam as associações causais como certas, prováveis, possíveis ou improváveis), apenas um evento foi certamente causado por um SF, nove foram provavelmente causados por SF e sete casos adicionais de provável ou certa hipersensibilidade causada por a DES foram identificados posteriormente.
32
Em dois casos, os sinais de alergia foram certamente causados pelo clopidogrel. Em quatro pacientes com hipersensibilidade focal, o exame necróptico encontrou infiltrados eosinofílicos instantâneos e má cicatrização da íntima até 18 meses após o implante, possivelmente causado por SF.
O estudo RADAR concluiu que os componentes metálicos e não metálicos do DES podem induzir hipersensibilidade. Em relação aos medicamentos impregnados nos stents, o sirolimus é uma causa improvável de hipersensibilidade porque normalmente reduz a infiltração eosinofílica e a liberação de histamina e tem sido associado a baixas taxas de hipersensibilidade.
33
mas a incidência de reações alérgicas ao próprio Paclitaxel não é conhecida.
34
A matriz de polímero pode se fragmentar e expor a estrutura metálica,
35
levantando a preocupação de que o níquel, cromo e molibdênio possam induzir hipersensibilidade, portanto, o revestimento de polímero pode causar reações alérgicas tardias e persistentes.
36
Em conclusão, os resultados do estudo sugerem que a hipersensibilidade local e sistêmica pode se desenvolver em resposta ao implante de SF nas artérias coronárias. Mas, como os ensaios clínicos com milhares de pacientes não relataram aumento da mortalidade com DES em comparação com stents convencionais,
37
,
38
a incidência de eventos fatais de hipersensibilidade devido aos SF é provavelmente muito baixa.
A relação entre a reação alérgica ao metal e o desenvolvimento de reestenose instantânea em pacientes tratados com stents de aço inoxidável de 316 L foi investigada anteriormente. Em geral, estudos clínicos anteriores sugeriram um aumento da propensão para reestenose recorrente em pacientes com hipersensibilidade a metais.
Köster et al
26
mostraram que uma reação de hipersensibilidade tardia ao níquel e ao molibdênio pode ser parte do processo inflamatório e um dos fatores desencadeantes da reestenose. Seu grupo realizou teste de remendo para alergia a metal em 131 pacientes submetidos a angiografia repetida por suspeita de reestenose, aproximadamente 6 meses após o implante de stent metálico. Destes, todos os 10 pacientes que apresentaram reações de adesivo positivas apresentaram reestenose instantânea. Em contraste, apenas 79 (65%) dos 121 pacientes restantes (que eram negativos para o adesivo) tiveram reestenose. Portanto, a diferença estatisticamente significativa (p = 0,03) sugere que a reação alérgica ao metal implantado foi um gatilho para reestenose.
No mesmo padrão, Iijima et al
27
descobriram que o teste de remendo positivo foi um preditor significativo de reestenose recorrente em pacientes tratados com stents de aço inoxidável de 316 L (
p
= 0,02).
Outra pesquisa de Aliağaoğlu et al
39
inscreveram 256 pacientes que receberam stent coronário de cobalto-cromo. A angiografia coronária e o patch test foram realizados de forma independente em 61 casos e reestenose instantânea foi encontrada em 31 deles. De acordo com os resultados do teste de contato, 7 dos 31 pacientes (23%) do grupo com reestenose tinham alergia de contato ao níquel, enquanto nenhum dos 30 pacientes (0%) do grupo sem reestenose tinha alergia ao níquel e a diferença foi encontrada estatisticamente significativo (
p
~ 0,006). Portanto, os resultados do estudo mostraram uma correlação entre alergia ao níquel e reestenose instantânea em pacientes tratados com stents de cobalto-cromo.
Uma preocupação específica foi levantada em relação aos stents folheados a ouro que pareciam induzir hipersensibilidade sistêmica ou focal.
Svedman et al
28
,
40
,
41
investigaram qualquer possível relação entre alergia de contato ao material do stent, especialmente níquel e ouro, e reestenose da artéria coronária. Eles descobriram que as taxas de reestenose eram maiores em pacientes alérgicos ao ouro do que em pacientes não alérgicos. Esses stents não estão mais em uso.
Em outro estudo, Saito et al procuraram uma correlação entre a positividade do patch e reestenose em pacientes com stent.
42
Assim, a positividade do patch foi significativamente mais frequente (p ~ 0,02) em um grupo com reestenose recorrente (9/23) em comparação com o grupo de não recorrência (5/42), levando os autores a sugerir que a reação do tecido ao componente metálico do 316 L, especialmente o níquel, pode desempenhar um papel importante na reestenose refratária crônica.
Os stents coronários não são os únicos que podem determinar a hipersensibilidade. Também há casos de stents periféricos (de Nitinol, com alto teor de níquel) descritos na literatura, que levaram a reações alérgicas.
43
Há alguns casos relatados de alergia significativa ao stent, que exigiu a remoção do dispositivo médico contendo níquel (o que pode ou não ser viável).
Em outro exemplo - uma mulher de 70 anos desenvolveu prurido generalizado e erupção cutânea, que apareceu logo após o implante de um stent metálico ilíaco; a única forma de aliviar os sintomas era a retirada do stent.
44
Da mesma forma, houve relatos de sintomas sistêmicos graves ocorridos após a colocação de dispositivos de fechamento do forame oval patente, sintomas que foram resolvidos com a remoção do dispositivo.
45
Em outro estudo com 47 pacientes que foram submetidos ao fechamento do forame oval patente usando um dispositivo Amplatzer (50% de níquel), 5 pacientes (dos 8 posteriormente identificados como alérgicos ao níquel por teste de adesivo) relataram um aumento na frequência de enxaqueca, dor no peito e palpitações após a colocação do dispositivo, significativamente mais frequentes do que o relatado por indivíduos controle não alérgicos.
46
No entanto, não houve falha do implante ou diferenças detectáveis no desempenho do dispositivo no grupo de alergia em comparação com os controles.
Por outro lado, Norgaz e cols. Não encontraram diferença entre alergia ao níquel em pacientes com reestenose e casos sem reestenose.
47
Portanto, o estudo não apoiou a relação entre alergia ao níquel e o desenvolvimento de reestenose em pacientes com stents de aço inoxidável.
Outro pequeno estudo da Dinamarca identificou 17 pacientes que receberam stents no passado recente e desenvolveram dermatite como uma alergia ao níquel ou ao cromo.
48
Apenas 2 pacientes tiveram que repetir a intervenção coronária, estatisticamente semelhante aos pacientes não alérgicos.
Na análise de Slodownik, 99 pacientes foram acompanhados - 70 pacientes tinham stents pérvios no segundo angiograma (grupo de stent pérvio) e 29 tinham reestenose de instent (grupo reestenose).
49
Vinte e oito (28,3%) pacientes apresentaram alergia a pelo menos um metal. Não houve diferença significativa na prevalência de alergia a metais entre o grupo de stent patente e o grupo de reestenose (28,6 e 27,6%, respectivamente;
p
= 0,921). Seus resultados não sustentam a teoria de que a alergia ao metal desempenha um papel na patogênese da reestenose instantânea.
Outro estudo retrospectivo também sugere que o implante de stent coronário em pacientes com histórico de alergia a metais não está associado a resultados cardiovasculares adversos precoces ou tardios. Romero-Brufau et al compararam 29 pacientes alérgicos a metal submetidos a implante de stent coronário a um grupo não alérgico (250 pacientes) pareado por dados demográficos e propensão para alergia a metal.
50
Não houve diferenças no número de segmentos tratados, stents colocados e frequência de uso de stent farmacológico. Em relação à morte hospitalar, infarto do miocárdio, mortalidade em 30 dias e IM, mortalidade em 4 anos, revascularização da lesão alvo (TLR) e morte / IM / TLR não foram encontradas diferenças estatísticas.
Considerando tudo isso, os resultados clínicos após a colocação de stent em pacientes com história de alergia a metais permanecem obscuros e os mecanismos permanecem incompletamente compreendidos.
As reações de hipersensibilidade podem ser causadas não apenas pela matriz metálica do stent, mas também pelo revestimento polimérico (no caso do DES).
A estrutura do DES inclui uma matriz polimérica, que permite a distribuição de drogas antiproliferativas para inibir o crescimento das células do músculo liso vascular.
DES de primeira geração foi baseado em carreadores de drogas poliméricas bioestáveis, como poli (etileno-co-vinil acetato) (PEVA), poli (n-butil metacrilato) (PBMA) e poli (estireno-b-isobutileno-b-estireno ) polímeros de bloco (SIBS). Foram relatadas reações de hipersensibilidade
51
,
52
e a persistência dos revestimentos poliméricos após a liberação do fármaco, causando má reendotelização e favorecendo a trombose tardia do stent.
53
Portanto, o DES de segunda geração foi desenvolvido com polímeros biodegradáveis capazes de se degradar (em um período de 6–24 meses) uma vez que sua função seja cumprida. Isso resultou em uma diminuição na trombose tardia e muito tardia do stent e também nas reações de hipersensibilidade.
Representantes típicos de polímeros biodegradáveis (que se degradam fisiologicamente por hidrólise) são ácidos poli-hidroxicarboxílicos, como poliglicolídeo (PGA), poli-lactídeos (PLA) e poli-caprolactona (PCL). O PLA tem sido intensamente testado como material de stent temporário em cardiologia devido ao seu longo histórico de biocompatibilidade in vivo.
54
Alguns polímeros (considerados mais biocompatíveis), como o PLA sintético, precisam de anos para se degradar e, portanto, apresentam o risco de trombose de stent tardia ou muito tardia. Além disso, o PGA pode gerar fragmentos que podem levar a êmbolos.
55
Portanto, os polímeros bioreabsorvíveis apresentam riscos e são um trabalho em andamento.
56
Os DES de segunda e terceira geração usam polímeros biomiméticos (como fosforilcolina - PC, fluoreto de polivinilideno-hexafluoropropileno - PVDF-HFP ou o polímero BioLinx), que não interferem na reendotelização do stent.
57
Recentemente, polímeros biodegradáveis (como PLA e polilactídeo-co-glicolídeo - PLGA) e DES livres de polímero foram amplamente estudados para otimizar sua biocompatibilidade.
58
No entanto, vários estudos relatam que os pacientes tratados com stents livres de polímero apresentam resultados clínicos semelhantes aos tratados com SF de polímero durável em termos de mortalidade, trombose do stent e eficácia a longo prazo.
59
A ideia de uma estrutura totalmente biodegradável pode reduzir os requisitos para uma terapia antiplaquetária dupla de longo prazo e facilitar o retorno da vasomoção dos vasos.
60
Os andaimes aprovados clinicamente são baseados principalmente em PLA (um polyL-lactide - PLLA e um polyD, L-lactide - PDLLA). Atualmente, existem algumas desvantagens em relação às reações inflamatórias agressivas durante a erosão do polímero, levando à reestenose instantânea.
61
Portanto, as tarefas futuras para o desenvolvimento de biomateriais usados para aplicações médicas não são apenas adaptar os desenhos dos stents, mas encontrar e promover biomateriais com propriedades antitrombóticas e antiinflamatórias.
Trombose de stent / Síndrome de Kounis
A trombose de stent é uma complicação dramática do implante de stent coronário, frequentemente apresentada como infarto agudo do miocárdio ou mesmo morte súbita. Com base no momento de implantação do stent, a trombose do stent pode ser classificada como precoce (0-30 dias após o implante do stent); atrasado (> 30 dias); muito tarde (> 12 meses). A trombose tardia e muito tardia do stent está associada a uma variedade de causas, como má endotelização, inflamação, cicatrização retardada, neoaterosclerose e reação de hipersensibilidade local.
62
Casos de trombose de stent devido a alergia a stent
27
,
38
foram relatados até 2–3 anos após o implante do stent porque a sensibilização ao níquel pode persistir por muitos anos.
63
A trombose do stent é o resultado da adesão, ativação e agregação de plaquetas em série. A agregação plaquetária é o resultado da ligação do receptor GP IIb / IIIa com fibrinogênio e interação com VWF. A trombina converte fibrinogênio em fibrina, que serve como uma matriz estável para a criação de trombo. Portanto, receptores de mediadores de hipersensibilidade também participam da ativação plaquetária e esses mediadores são derivados da unidade alérgica de eosinófilos e mastócitos.
64
Isso pode explicar por que os pacientes podem desenvolver trombose de stent durante um episódio alérgico.
Por outro lado, a inflamação endotelial local (molécula de adesão intercelular-1 que recruta células inflamatórias da corrente sanguínea
65
) e resposta imunológica excessiva (uma reação de hipersensibilidade do tipo IV mediada por linfócitos T específicos para alérgenos
15
) desempenham papéis importantes na ocorrência de trombose de stent.
A inflamação crônica e a disfunção endotelial induzem neoaterosclerose em longo prazo dentro de stents convencionais e farmacológicos, e a ruptura de placas neoateroscleróticas desempenha um papel importante na ocorrência de trombose de stent tardia e especialmente, muito tardia.
66
Uma vez que a inflamação é uma das principais causas de trombose de stent,
67
a administração sistêmica de terapia antiinflamatória ou imunossupressora (corticóide oral após ICP quando é confirmada alergia ao metal), além da terapia antiplaquetária dupla, pode ser benéfica na supressão da inflamação vascular e na redução das taxas de trombose de stent.
68-70
Konishi et al relataram um caso com trombose de stent recorrente em um paciente com alergia comprovada ao stent que pode se beneficiar da corticoterapia sistêmica.
71
Além da terapia antiplaquetária, baixas doses de esteroides podem conferir benefícios clínicos e diminuir a incidência de
trombose de stent devido às suas propriedades antiinflamatórias.Em um estudo post-mortem, infiltrações eosinofílicas foram observadas no local do stent em pacientes com trombose de stent associada a alergias ao stent.
51
,
72
Portanto, os pacientes que desenvolvem trombose repetitiva de stent após o implante de stent devem ser submetidos a patch test em busca de alergia a metais.
Estudos recentes relataram uma baixa incidência de trombose de stent após o implante de scaffolds vasculares bioreabsorvíveis, onde o risco é acentuadamente diminuído após a eluição do fármaco antiproliferativo e a reabsorção do scaffold. Essa evidência pode ser muito importante em pacientes que apresentam alergia a stent submetidos a ICP e que podem se beneficiar com esses dispositivos.
73
Outra situação em que a doença cardíaca coronária interfere nos processos patogênicos alérgicos é a síndrome de Kounis.
A síndrome de Kounis é uma síndrome coronariana aguda, secundária a uma reação alérgica. Nesses casos, a liberação de citocinas pode precipitar espasmo coronário, ruptura de placa ou trombose de stent.
Existem 3 tipos descritos - o tipo III (cerca de 5% dos casos de síndrome de Kounis) inclui pacientes com trombose de stent de artéria coronária como resultado de uma reação alérgica, com presença histologicamente demonstrada de mastócitos e eosinófilos do trombo aspirado.
74
,
75
Vários casos de síndrome de Kounis tipo III foram relatados na literatura.
Tzanis et al descreveram um caso curioso de trombose de stent precoce (4 dias após o implante) após uma reação alérgica ao consumo de alimentos em um homem de 70 anos.
76
Em outro relato, Tripolino e cols. Descreveram o caso de um homem de 47 anos com trombose aguda de stent, em consequência de reação alérgica a meio de contraste.
77
Após 30 minutos do término da angioplastia (implante de stent LAD), o paciente apresentou náusea, sudorese, dor torácica, coceira generalizada seguida de aparecimento de eritema cutâneo. O ECG revelou elevação significativa do segmento ST em V2-V5 e a angiografia coronária imediata mostrou trombose completa do stent.
O tratamento incluiu hidrocortisona, clorfeniramina, oxigênio, infusão de soro fisiológico e a angioplastia foi repetida com bom resultado.
Michas e cols. Relataram um caso de infarto do miocárdio com supradesnivelamento de ST devido a trombose de stent no cenário de uma reação alérgica associada ao consumo de cogumelos.
78
A síndrome de Kounis pode ser outro exemplo da ligação entre o implante de stent e reações alérgicas, às vezes resultando em complicações graves, como reestenose e trombose de stent - ver
tabela 1
.
tabela 1
Estudos ou relatos de casos sobre os efeitos colaterais dos stents
Um cuidado especial deve ser prestado a pacientes com múltiplas síndromes autoimunes e implantação de stent.
79
Em pacientes diabéticos, a aterosclerose é mais persistente e agressiva do que em pacientes não diabéticos e o risco cardiovascular é particularmente alto; portanto, os casos de doença isquêmica do coração e derrame cerebral são mais do que o dobro na população diabética do que na população não diabética.
80
Por isso, o tratamento do paciente diabético com doença coronariana deve ser muito mais intensivo; Os stents farmacológicos (DES) são, portanto, um grande avanço no campo das terapias intervencionistas nesses pacientes.
No entanto, tanto a trombose de stent quanto a reestenose de instent são mais comuns em pacientes com diabetes. A reestenose após o implante de stent, causada por hiperplasia neointimal, continua sendo uma grande preocupação, especialmente para a população diabética. Em uma meta-análise de seis estudos, as taxas médias de reestenose entre pacientes com diabetes foram 50% maiores do que em não diabéticos.
81
O diabetes também é um importante fator de risco para trombose de stent. Em um estudo, a taxa de trombose de stent foi 1,8 vezes maior em pacientes diabéticos do que em não diabéticos (3,2% vs 1,7%).
82
Essas são algumas das razões pelas quais a cirurgia de revascularização do miocárdio é freqüentemente preferida à angioplastia em pacientes diabéticos. No entanto, não há evidências fortes de um maior risco de hipersensibilidade a stents em pacientes diabéticos do que em pacientes não diabéticos.
Por outro lado, os especialistas não consideram o risco de alergias secundárias ao implante de stent um grande problema.
Morton Kern respondeu com um NÃO triplo para esta questão de stents coronários. NÃO, eu não faço teste para alergia ao níquel. NÃO, eu não trato pacientes com alergia ao níquel. E, finalmente, NÃO, eu não escolho stents por medo de alergia.
83
O Dr. Greg Stone, da Columbia University, NYC, também comentou: “A maioria dos estudos não encontrou uma relação firme entre a alergia ao níquel e a reestenose”.
Portanto, apesar das evidências teóricas e dos casos relatados a respeito da relação entre o implante do stent e as reações alérgicas subsequentes, não podemos saber atualmente a magnitude desse problema.
Apesar de ser uma terapia que salva vidas, os stents coronários podem ocasionalmente causar eventos adversos graves para esses pacientes. A matriz metálica, revestimento de polímero, fármacos eluídos, antiagregantes plaquetários e outros fármacos (que os pacientes com stent estão tomando) atuam como um forte complexo antigênico capaz de induzir uma reação alérgica e algumas complicações como reestenose instintiva e trombose stent.
84
,
85
São necessários novos ensaios sólidos e diretrizes baseadas em evidências para avaliação de risco, testes diagnósticos e tratamento. Reações semelhantes podem ocorrer após outros tipos de cirurgia com ou sem inoculação de materiais considerados não próprios.
Conclusões
Embora a reestenose e a trombose do stent sejam consideradas complicações multifatoriais, variáveis do procedimento, clínicas e angiográficas também foram incriminadas.
Os especialistas devem educar os colegas sobre essas complicações potenciais. Os pacientes devem ser questionados sobre sua história alérgica e informados sobre riscos aumentados antes da colocação de stents intracoronários.
Embora existam vozes que minimizam essa conexão, o problema não deve ser negligenciado.
Pelo menos em pacientes com stent que sofrem de reestenose recorrente ou trombose de stent, a hipersensibilidade aos componentes do stent provavelmente desempenha um papel importante e deve ser uma grande preocupação. Resta provar se, nesses casos, a terapia antiinflamatória ou imunossupressora (além da medicação antiplaquetária dupla) pode ser útil para limitar esses efeitos colaterais.
Declaração de Compartilhamento de Dados
Todas as informações são documentadas por referências relevantes.
Contribuições do autor
Todos os autores deram uma contribuição significativa para o trabalho relatado, seja na concepção, desenho do estudo, execução, aquisição de dados, análise e interpretação, ou em todas essas áreas; participou da redação, revisão ou revisão crítica do artigo; deu aprovação final da versão a ser publicada; concordar com a revista para a qual o artigo foi submetido; e concordou em ser responsável por todos os aspectos do trabalho.
Financiamento
Nenhum financiamento foi recebido.
Divulgação
Os autores declaram não ter interesses conflitantes.
Referências
1
Krenning van Luyn GMJ, Harmsen MC. Neovascularização baseada em células progenitoras endoteliais: implicações para a terapia.
Trends Mol Med
. 2009; 15 (4): 180–189.
2
Liu T, Liu S, Zhang K, Chen J, Huang N. Endotelização de superfícies de biomateriais cardiovasculares implantadas: o desenvolvimento de in vitro para in vivo.
J Biomed Mater Res A
. 2014; 102 (10): 3754–3772.
3
Lee JH, Kim ED, Jun EJ, Yoo HS, Lee JW. Análise de tendências e perspectivas de stents para vasos sanguíneos humanos.
Pesquisa de Biomateriais
. 2018; 22: 8.
4
Wenaweser P, Rey C, Eberli FR, et al. Trombose de stent após implante de stent convencional: sucesso de intervenção coronária percutânea de emergência e preditores de resultados adversos.
Eur Heart J
. 2005; 26 (12): 1180–1187.
5
Windecker S, Meier B. Late coronary stent thrombosis.
Circulação
. 2007; 116 (17): 1952–1965.
6
Morice MC, Serruys PW, Fajadet J, et al. Grupo de estudo RAVEL - estudo randomizado com o stent expansível por balão de velocidade bx revestido com sirolimus no tratamento de pacientes com lesões de novo da artéria coronária nativa uma comparação randomizada de um stent eluidor de sirolimus com um stent padrão para revascularização coronária.
N Engl J Med
. 2002; 346 (23): 1773–1780.
7
Moses J, Leon M, Popma J, et al. For the SIRIUS Investigators - Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery.
N Engl J Med
. 2003;349:1315–1323.
8
Mohan S, Dhall A. A comparative study of restenosis rates in bare metal and drug-eluting stents.
Int J Angiol
. 2010;19(2):e66–e72. doi:10.1055/s-0031-1278368,
9
Auer J, Leitner A, Berent R, et al. Long-term outcomes following coronary drug-eluting- and bare-metal-stent implantation.
Atherosclerosis
. 2010;210(2):503–509. doi:10.1016/j.2010
10
Buccheri D, Piraino D, Andolina G, Cortese B. Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment.
J Thorac Dis
. 2016;8(10):E1150–E1162. doi:10.21037/jtd.2016
11
Mohananey D, Saucedo J, Stone GW, et al. Trends and outcomes of restenosis after coronary stent implantation in the United States.
J Am Coll Cardiol
. 2020;76(13):1521–1531.
12
Mauri L, Hsieh WH, Massaro JM, Ho KK, D'Agostino R, Cutlip DE. Stent thrombosis in randomized clinical trials of drug-eluting stents.
N Engl J Med
. 2007;356:1020–1029.
13
Jensen LO, Maeng M, Kaltoft A, et al. Stent thrombosis, myocardial infarction, and death after drug-eluting and bare-metal stent coronary interventions.
J Am Coll Cardiol
. 2007;50:463–470.
14
Brener SJ, Cristea E, Kirtane AJ, et al. Intra-procedural stent thrombosis: a new risk factor for adverse outcomes in patients undergoing percutaneous coronary intervention for acute coronary syndromes.
JACC Cardiovasc Interv
. 2013;6(1):36–43.
15
Généreux P, Stone GW, Harrington RA; CHAMPION PHOENIX Investigators, et al.. Impact of intraprocedural stent thrombosis during percutaneous coronary intervention: insights from the CHAMPION PHOENIX trial (Clinical trial comparing cangrelor to clopidogrel standard of care therapy in subjects who require percutaneous coronary intervention).
J Am Coll Cardiol
. 2014;63(7):619.
16
Chen JP, Hou D, Pendyala L, Goudevenos JA, Kounis NG. Drug-eluting stent thrombosis: the Kounis hypersensitivity-associated acute coronary syndrome revisited.
J Am Coll Cardiol Cardiovasc Interv
. 2009;2:583–593.
17
Basko-Plluska JL, Thyssen JP, Schalock PC. Cutaneous and systemic hypersensitivity reactions to metallic implants.
Dermatitis
. 2011;22:65–79.
18
Nielsen NH, Linneberg A, Menne T, et al. Incidence of allergic contact sensitization in Danish adults between 1990 and 1998; the Copenhagen Allergy Study, Denmark.
Br J Dermatol
. 2002;147:487–492.
19
Wataha JC, O'Dell NL, Singh BB, Whitford GM, Lockwood PE. Relating nickel-induced tissue inflammation to nickel release in vivo.
J Biomed Mater Res
. 2001;58:537–544.
20
Thomas P, Summer B, Sander CA, Przybilla B, Thomas M, Naumann T. Intolerance of osteosynthesis material: evidence of dichromate contact allergy with concomitant oligoclonal T-cell infiltrate and TH1-type cytokine expression in the peri-implantar tissue.
Allergy
. 2000;55:969–972.
21
Kornowski R, Hong MK, Tio FO, Bramwell O, Wu H, Leon MB. In-stent restenosis: contributions of inflammatory responses and arterial injury to neointimal hyperplasia.
J Am Coll Cardiol
. 1998;31:224–230.
22
Beyar R. Novel approaches to reduce restenosis.
Ann NY Acad Sci
. 2004;1015:367–378.
23
Radke PW, Kaiser A, Frost C, Sigwart H. Outcome after treatment of coronary in-stent restenosis: results from a systematic review using meta-analysis techniques.
Eur Heart J
. 2003;24:266–273.
24
Cutlip DE, Chauhan MS, Baim DS, et al. Clinical restenosis after coronary stenting: perspectives from multicenter clinical trials.
J Am Coll Cardiol
. 2002;18:2082–2089.
25
Schiele TM, Krotz F, Klauss V. Vascular restenosis striving for therapy.
Expert Opin Pharmacother
. 2004;5:2221–2232.
26
Köster R, Vieluf D, Kiehn M, et al. Nickel and molybdenum contact allergies in patients with coronary in-stent restenosis.
Lanceta
. 2000;356:1895–1897.
27
Iijima R, Ikari Y, Amiya E, et al. The impact of metallic allergy on stent implantation: metal allergy and recurrence of in-stent restenosis.
Int J Cardiol
. 2005;104:319–325.
28
Svedman C, Ekqvist S, Moller H, et al. A correlation found between contact allergy to stent material and restenosis of the coronary arteries.
Contact Dermatitis
. 2009;60:158–164.
29
Bennett CL, Nebeker JR, Lyons EA, et al. The Research on Adverse Drug Events and Reports (RADAR) project.
JAMA
. 2005;293:2131–2140.
30
Information for Physicians on Sub-Acute Thromboses (SAT) and Hypersensitivity Reactions with Use of the Cordis CYPHER Coronary Stent.
FDA Public Health Web Notification
.
1st
ed. Rockville, MD: Food and Drug Administration; 2003.
31
Updated Information for Physicians on Sub-acute Thromboses (SAT) and Hypersensitivity Reactions with Use of the Cordis CYPHER Sirolimus-eluting Coronary Stent.
FDA Public Health Web Notification
.
1st
ed. Rockville, MD: Food and Drug Administration; 2003.
32
Nebeker JR, Barach P, Samore MH. Clarifying adverse drug events: a clinician's guide to terminology, documentation, and reporting.
Ann Intern Med
. 2004;140:795–801.
33
Mosby's Drug Consult 2004 - The Comprehensive Reference for Generic and Brand Name Drugs
. St. Louis, MO: Elsevier Inc.; 2004.
34
Rowinsky EK, Donehower RC. Paclitaxel (Taxol).
N Engl J Med
. 1995;332:1004–1014.
35
Virmani R, Guagliumi G, Farb A, et al. Localized hypersensitivity and late coronary thrombosis secondary to a sirolimus-eluting stent: should we be cautious?
Circulation
. 2004;109:701–705.
36.
Hillen U, Haude M, Erbel R, Goos M. Evaluation of metal allergies in patients with coronary stents.
Contact Dermatitis
. 2002;47:353–356.
37.
Moses JW, Leon MB, Popma JJ, et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery.
N Engl J Med
. 2003;349:1315–1323.
38.
Stone GW, Ellis SG, Cox DA, et al. One-year clinical results with the slow-release, polymer-based, paclitaxel-eluting TAXUS stent: the TAXUS-IV trial.
Circulation
. 2004;109:1942–1947.
39.
Aliağaoğlu C, Turan H, Erden I, et al. Relation of nickel allergy with in-stent restenosis in patients treated with cobalt chromium stents.
Ann Dermatol
. 2012;24:4.
40.
Svedman C, Tillman C, Gustavsson CG, Moller H, Frennby B, Bruze M. Contact allergy to gold in patients with gold-plated intracoronary stents.
Contact Dermatitis
. 2005;52:192–196.
41.
Svedman C, Lundh T, Tillman C, Moller H, Gustavsson CG, Bruze M. Gold concentration in blood in patients with gold-plated stents.
Contact Dermatitis
. 2006;54:221–222.
42.
Saito T, Hokimoto S, Oshima S, Noda K, Kojyo Y, Matsunaga K. Metal allergic reaction in chronic refractory in-stent restenosis.
Cardiovasc Revasc Med
. 2009;10:17–22.
43.
Chioncel V, Brezeanu R, Sinescu C. New directions in the management of peripheral artery disease.
Am J Ther
. 2019;26(2):e284–e293.
44.
Guntani A, Kawakubo E, Ryosuke Yoshiga R, et al. Metallic allergy requiring removal of iliac stent: report of a case.
Surg Case Rep
. 2020;6:82.
45.
Khodaverdian RA, Jones KW. Metal allergy to Amplatzer occlude device presented as severe bronchospasm.
Ann Thorac Surg
. 2009;88:2021–2022.
46.
Slavin L, Tobis JM, Rangarajan K, Dao C, Krivokapich J, Liebeskind DS. Five-year experience with percutaneous closure of patent foramen ovale.
Am J Cardiol
. 2007;99:1316–1320.
47.
Norgaz T, Hobikoglu G, Serdar ZA, et al. Is there a link between nickel allergy and coronary stent restenosis?
Tohoku J Exp Med
. 2005;206:243–246.
48.
Thyssen JP, Engkilde K, Menne T, Johansen JD, Hansen PR, Gislason GH. No association between metal allergy and cardiac in-stent restenosis in patients with dermatitis-results from a linkage study.
Contact Dermatitis
. 2011;64:138–141.
49.
Slodownik C, Danenberg C, Merkin D, et al. Coronary stent restenosis and the association with allergy to metal content of 316L stainless steel.
Cardiovasc J Afr
. 2018;29:43–45.
50.
Romero-Brufau S, Best PJM, Holmes DR, et al. Outcomes after coronary stent implantation in patients with metal allergy.
Circ Cardiovasc Interv
. 2012;5:220–226.
51.
Virmani R, Kolodgie FD, Farb A. Drug-eluting stents: are they really safe?
Am Heart Hosp J
. 2004;2(2):85–88.
52.
Nebeker R, Virmani C, Bennett L, et al. Hypersensitivity cases associated with drug-eluting coronary stents: a review of available cases from the Research on Adverse Drug Events and Reports (RADAR) project.
J Am Coll Cardiol
. 2006;47(1):175–181.
53.
Farb A, Burke AP, Kolodgie FD, Virmani R. Pathological mechanisms of fatal late coronary stent thrombosis in humans.
Circulation
. 2003;108(14):1701–1706.
54.
van Alst M, Eenink MJD, Kruft MAB, Van Tuil R. ABC's of bioabsorption: application of lactide based polymers in fully resorbable cardiovascular stents.
EuroIntervention
. 2009;5:F23–F27.
55.
Ceonzo K, Gaynor A, Shaffe L, Kojima K, Vacanti CA, Stahl GL. Polyglycolic acid-induced inflammation: role of hydrolysis and resulting complement activation.
Tissue Eng
. 2006;12(2):301–308.
56.
Serruys PW, Kukreja N. Late stent thrombosis in drug eluting stents: return of the 'VB syndrome'.
Nat Clin Pract Cardiovasc Med
. 2006;3(12):637.
57.
Ong AT, Serruys PW. Technology insight: an overview of research in drug-eluting stents.
Nat Clin Pract Cardiovasc Med
. 2005;2(12):647–658.
58.
Patel MJ, Patel SS, Patel NS, Patel NM. Current status and future prospects of drug eluting stents for restenosis.
Acta Pharmaceutica
. 2012;62(4):473–496.
59.
Navarese EP, Kowalewski M, Cortese B, et al. Short and long term safety and efficacy of polymer-free vs. durable polymer drug-eluting stents.A comprehensive meta-analysis of randomized trials including 6178 patients.
Atherosclerosis
. 2014;233(1):224–231.
60.
Campos CM, Muramatsu T, Iqbal J, et al. Bioresorbable drug-eluting magnesium-alloy scaffold for treatment of coronary artery disease.
Int J Mol Sci
. 2013;14(12):24492–24500.
61.
Smith EJ, Jain AK, Rothman MT. New developments in coronary stent technology.
J Interv Cardiol
. 2006;19(6):493–499.
62.
Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk.
J Am Coll Cardiol
. 2006;48:193–202.
63.
Nguyen SH, Dang TP, MacPherson C, Maibach H, Maibach HI. Prevalence of patch test results from 1970 to 2002 in a multi-centre population in North America (NACDG).
Contact Dermatitis
. 2008;58:101–106.
64.
Minai-Fleminger Y, Levi-Schaffer F. Mast cells and eosinophils: the two key effector cells in allergic inflammation.
Inflamm Res
. 2009;58:e631–e638.
65.
Wataha JC, O'Dell NL, Singh BB, Ghazi M, Whitford GM, Lockwood PE. Relating nickel-induced tissue inflammation to nickel release in vivo.
J Biomed Mater Res
. 2001;58:537–544.
66.
Nakazawa G, Otsuka F, Nakano M, et al. The pathology of neoatherosclerosis in human coronary implants bare-metal and drug-eluting stents.
J Am Coll Cardiol
. 2011;57:1314–1322.
67.
Farb A, Sangiorgi G, Carter AJ, et al. Pathology of acute and chronic coronary stenting in humans.
Circulation
. 1999;99:44–52.
68.
Ribichini F, Tomai F, De Luca G, et al. Immunosuppressive therapy with oral prednisone to prevent restenosis after PCI. A multicenter randomized trial.
Am J Med
. 2011;124:434–443.
69.
Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids–new mechanisms for old drugs.
N Engl J Med
. 2005;353:1711–1723.
70.
Chioncel V, Avram A, Sinescu C. A particular case of Wellens' syndrome.
Med Hypotheses
. 2020;144:110013.
71.
Konishi T, Yamamoto T, Funayama T, et al. Stent thrombosis caused by metal allergy complicated by protein S deficiency and heparin-induced thrombocytopenia: a case report and review of the literature.
Thromb J
. 2015;13:25.
72.
Tatu AL, Baroiu L, Fotea S, et al. A working hypothesis on vesicular lesions related to COVID-19 infection, Koebner Phenomena Type V, and a short review of related data.
Clin Cosmet Investig Dermatol
. 2021;14:419–423.
73.
Verheye S, Ormiston JA, Stewart J, et al. A next-generation bioresorbable coronary scaffold system: from bench to first clinical evaluation: 6- and 12-month clinical and multimodality imaging results.
JACC Cardiovasc Interv
. 2014;7:89–99.
74.
Sciatti E, Vizzardi E, Cani DS, et al. Kounis syndrome, a disease to know: case report and review of the literature.
Monaldi Arch Chest Dis
. 2018;88:898.
75.
Kounis NG. Coronary hypersensitivity disorder: the Kounis syndrome.
Clin Ther
. 2013;35:563–571.
76.
Tzanis G, Bonou M, Mikos N, et al. Early stent thrombosis secondary to food allergic reaction: kounis syndrome following rice pudding ingestion.
World J Cardiol
. 2017;9:283–288.
77.
Tripolino C, Tassone EJ, Morabito G, Grillo P, Missiroli B. Acute coronary stent thrombosis: a case of type 3 Kounis syndrome.
J Cardiol Cases
. 2019;19:33–35.
78.
Michas G, Stougiannos P, Thomopoulos T, et al. Acute anterior myocardial infarction due to stent thrombosis after mushroom consumption: a case of Kounis type III syndrome.
Hellenic J Cardiol
. 2017;58:378–380.
79.
Tatu AL, Ionescu MA. Multiple autoimmune syndrome type III - thyroiditis, vitiligo and alopecia areata.
Acta Endo (Buc)
. 2017;13(1):124–125.
80.
Seabra‐Gomes R. Percutaneous coronary interventions with drug eluting stents for diabetic patients.
Heart
. 2006;92(3):410–419.
81.
Gilbert J, Raboud J, Zinman B. Meta‐analysis of the effect of diabetes on restenosis rates among patients receiving coronary angioplasty stenting.
Diabetes Care
. 2004;27:990–994.
82.
Machecourt J, Danchin N, Lablanche JM, et al. Risk factors for stent thrombosis after implantation of sirolimus-eluting stents in diabetic and nondiabetic patients: the EVASTENT matched-cohort registry.
J Am Coll Cardiol
. 2007;50(6–7):501–508.
83.
Kern M. How should we manage nickel allergy in patients needing coronary stents?
Cathlabdigest
. 2011;19:1.
84.
Tatu AL, Elisei AM, Chioncel V, Miulescu M, Nwabudike LC. Immunologic adverse reactions of β-blockers and the skin.
Exp Ther Med
. 2019;18(2):955–959.
85.
Kounis NG, Mazarakis A, Tsigkas G. Giannopoulos S and Goudevenos J. Kounis syndrome: a new twist on an old disease.
Future Cardiol
. 2011;7:e805–e824.




