Autores
Jin B, Hu W, Su S, Xu H, Lu X,
Sang X
,
Yang H
,
Mao Y
,
Du S
Recebido
28 de abril de 2021
Aceito para publicação
26 de julho de 2021
Publicados
10 de agosto de 2021 Volume 2021: 13 Páginas 6263-6277
DOI
https://doi.org/10.2147/CMAR.S317954
Verificado quanto a plágio
sim
Comentário por
Avaliação por pares anônima única
Comentários do revisor
3
Editor que aprovou a publicação:
Dr. Beicheng Sun
Baixar Artigo
[PDF]
Bao Jin,
1,
& ast;
Wenmo Hu,
2,
& ast;
Si Su,
2,
& ast;
Haifeng Xu,
1
Xin Lu,
1
Xinting Sang,
1
Huayu Yang,
1
Yilei Mao,
1
Shunda Du
1
1
Departamento de Cirurgia Hepática, Hospital Peking Union Medical College (PUMCH), Peking Union Medical College (PUMC) e Academia Chinesa de Ciências Médicas (CAMS), Pequim, 100730, República Popular da China;
2
Peking Union Medical College (PUMC) e Academia Chinesa de Ciências Médicas (CAMS), Pequim, 100730, República Popular da China & ast; Esses autores contribuíram igualmente para este trabalhoCorrespondência: Shunda Du; Yilei MaoDepartment of Liver Surgery, Peking Union Medical College (PUMC) Hospital, PUMC e Academia Chinesa de Ciências Médicas, Pequim, 100730, República Popular da ChinaE-mail
[email protegido]
;
[email protegido]
Propósito:
Determinamos o valor prognóstico do índice de resposta à inflamação sistêmica (SIRI) em pacientes com colangiocarcinoma após a cirurgia e construímos um modelo de previsão de sobrevida com base no SIRI.
Pacientes e métodos:
Recrutamos 328 pacientes com colangiocarcinoma confirmado histopatologicamente de 2003 a 2017 e realizamos análises de sobrevida de Kaplan-Meier e Cox para analisar o valor prognóstico do SIRI e identificar outros fatores significativos. Um nomograma envolvendo SIRI e outros fatores clínico-patológicos foi estabelecido com base na coorte de treinamento. O índice de concordância (índice C), análise da curva de decisão, gráficos de calibração e teste de Hosmer-Lemeshow foram usados para avaliar a utilidade clínica do nomograma e compará-lo com o sistema de estadiamento TNM tradicional. Os resultados foram validados usando uma coorte de validação separada.
Resultados:
Os pacientes foram divididos aleatoriamente em coortes de treinamento (n = 232) e validação (n = 96). Na coorte de treinamento, os fatores independentes derivados da análise multivariada de Cox foram SIRI, proporção de plaquetas para linfócitos, icterícia, nível de γ-glutamil transpeptidase, tamanho máximo do tumor, estágio N, estágio M e cirurgia radical. Curvas de características de operação do receptor dependente do tempo (ROC) mostraram AUC mais alta para SIRI do que para outros biomarcadores baseados em inflamação. Um nomograma contendo todos os fatores independentes mostrou boa discriminação e calibração. Os valores do índice C para a sobrevida global, 0,737 (95% Cl: 0,683–0,791) e 0,738 (95% Cl: 0,679– 0,797) nas coortes de treinamento e validação, respectivamente, foram significativamente melhores do que aqueles para o sistema de estadiamento TNM [ 0,576 (95% Cl: 0,515–0,637) e 0,523 (95% Cl: 0,465– 0,581), respectivamente].
Conclusão:
SIRI foi um fator prognóstico independente para colangiocarcinoma. Um modelo de prognóstico baseado no SIRI pode ajudar os médicos a estratificar os pacientes com mais precisão e fornecer tratamento individualizado.
Palavras-chave:
índice de resposta à inflamação sistêmica, colangiocarcinoma, prognóstico, nomograma, sobrevida
Introdução
Colangiocarcinoma, o segundo tumor maligno hepatobiliar mais comum após o carcinoma hepatocelular,
1
origina-se do epitélio das vias biliares e pode envolver qualquer parte da árvore biliar.
2
A incidência de colangiocarcinoma tem supostamente aumentado nos últimos anos,
3
,
4
com taxas ajustadas por idade entre 2,1 por 100.000 em populações negras e não hispânicas e 2,8–3,3 por 100.000 em asiáticos e hispânicos.
1
Como a maioria dos pacientes no estágio inicial são assintomáticos, uma grande proporção apresenta doença em estágio avançado na apresentação. Portanto, apenas cerca de 35% dos pacientes em estágio inicial têm chance de serem submetidos à ressecção cirúrgica com intenção curativa.
5
Além disso, quase 30% dos pacientes considerados ressecáveis nos testes de imagem iniciais são irressecáveis durante a exploração, resultando em margens positivas nos relatórios patológicos finais.
6
Todos esses fatores contribuem para o mau prognóstico dos pacientes com colangiocarcinoma, e a mortalidade é paralela à sua taxa de incidência (aproximadamente 1,0 por 100.000).
7
,
8
Assim, a previsão precisa do resultado de pacientes com colangiocarcinoma é urgentemente necessária. O sistema de estadiamento TNM é atualmente o padrão mais amplamente utilizado para o estadiamento do câncer. No entanto, outros fatores clínico-patológicos também podem desempenhar papéis cruciais na evolução dos pacientes com colangiocarcinoma, levando a uma heterogeneidade considerável no prognóstico clínico entre os pacientes com o mesmo estágio. Portanto, modelos de prognóstico mais precisos para colangiocarcinoma são urgentemente necessários no ambiente clínico.
É amplamente reconhecido que a resposta inflamatória é um fator importante no desenvolvimento e progressão do câncer.
9
Informações sobre algumas células imunoinflamatórias, como neutrófilos, monócitos, plaquetas e linfócitos, podem ser facilmente adquiridas por meio de um hemograma completo. Com base nisso, biomarcadores baseados em inflamação, incluindo proporção de neutrófilos para linfócitos (NLR), proporção de monócitos para linfócitos (MLR) e proporção de plaquetas para linfócitos (PLR) foram investigados, e seu valor prognóstico no colangiocarcinoma foi foi ilustrado.
10
,
11
Recentemente, Qi et al propuseram um biomarcador inovador baseado na inflamação que integra contagens periféricas de neutrófilos, monócitos e linfócitos, ou seja, o índice de resposta à inflamação sistêmica (SIRI).
12
Estudos subsequentes relataram a capacidade prognóstica de SIRI em tumores sólidos, como câncer de esôfago, estômago, pâncreas e nasofaringe.
13-15
No entanto, ainda faltam evidências que mostrem se o SIRI pode ser um indicador prognóstico para prever o resultado de pacientes com colangiocarcinoma. Além disso, até onde sabemos, ainda não existe um modelo prognóstico que inclua biomarcadores baseados em inflamação para colangiocarcinoma.
Portanto, nossa pesquisa teve como objetivo estudar o valor prognóstico do SIRI usando uma coorte de pacientes com colangiocarcinoma após a ressecção cirúrgica e construir um modelo prognóstico integrando o SIRI em uma coorte de treinamento e testar sua precisão preditiva em uma coorte de validação.
Pacientes e métodos
Pacientes
De 1º de janeiro de 2003 a 31 de dezembro de 2017, os pacientes que receberam tratamento cirúrgico em nossa instituição e cujo laudo patológico revelou colangiocarcinoma foram recrutados retrospectivamente para este estudo.
Os critérios de inclusão do estudo foram: (1) colangiocarcinoma como diagnóstico principal, que foi confirmado por exame histopatológico, (2) cirurgia realizada para colangiocarcinoma, (3) os resultados de exames de sangue de rotina medidos sete dias antes da cirurgia estavam disponíveis, e ( 4) os dados de acompanhamento pós-operatório e as informações clínico-patológicas estavam completos e disponíveis.
Os critérios de exclusão do estudo foram: (1) falta de diagnóstico histopatológico definitivo de colangiocarcinoma, (2) falta de informação clínico-patológica, (3) dados de seguimento incompletos e (4) presença comórbida de outros tumores malignos.
Após a triagem, os 328 pacientes que foram posteriormente inscritos preencheram os critérios de inclusão. A coorte inteira foi dividida aleatoriamente em coortes de treinamento e validação em uma proporção de 7: 3 usando o pacote “acento circunflexo” da versão R 3.6.2.
Declaração de ética
Este estudo foi aprovado pelo Comitê de Revisão Institucional do Peking Union Medical College Hospital (PUMCH) (No: S-K1110). O consentimento informado foi obtido de todos os pacientes de acordo com os regulamentos do Comitê. O estudo foi realizado de acordo com os padrões éticos da Declaração de Helsinque.
16
Coleção de dados
Os registros médicos relacionados foram revisados manualmente para obter informações demográficas e clínicas. Coletamos informações demográficas dos pacientes, sintomas clínicos, resultados de exames sorológicos, relatórios cirúrgicos e resultados histopatológicos. Biomarcadores inflamatórios, incluindo SIRI, NLR, MLR e PLR, foram definidos da seguinte forma: SIRI = N * M / L, NLR = N / L, MLR = M / L e PLR = P / L, onde N, M , L e P referem-se às contagens periféricas de neutrófilos, monócitos, linfócitos e plaquetas, respectivamente. A 7ª edição do sistema de classificação AJCC TNM foi usada para determinar os estágios pré-operatórios clínicos e pós-operatórios do TNM patológico.
17
As margens incisionais e o tamanho máximo do tumor foram determinados com base nos laudos histopatológicos finais. A cirurgia radical foi definida como a necessidade de protocolos cirúrgicos radicais com margens incisionais microscopicamente negativas. Todos os pacientes foram submetidos a acompanhamentos regulares após a alta. O último acompanhamento foi em junho de 2020, e o status de sobrevida dos pacientes foi registrado. A sobrevida global (SG) foi calculada com base no intervalo de tempo desde o momento da cirurgia até o momento do óbito ou último acompanhamento.
Análise Estatística
As variáveis contínuas são apresentadas como mediana, primeiro e terceiro quartis, enquanto as variáveis categóricas são expressas como números e porcentagens. De acordo com o valor de corte de rotina em aplicações clínicas, variáveis contínuas, como antígeno de carboidrato 19–9 (CA19-9) e antígeno carcinoembrionário (CEA), foram convertidas em variáveis categóricas. O valor de corte ideal para biomarcadores baseados em inflamação para OS foi calculado usando o software x-tile.
18
O método Kaplan-Meier foi usado para desenhar as curvas de sobrevivência. As diferenças entre os subgrupos foram comparadas usando testes de log rank. Os pacientes foram divididos em grupos de alto e baixo SIRI de acordo com o valor de corte ideal do SIRI. As correlações entre as variáveis clínico-patológicas e os grupos SIRI foram analisadas usando t de duas amostras ou Mann-Whitney
você
-testes para variáveis contínuas com base na normalidade e testes qui-quadrado de Pearson ou exato de Fisher para variáveis categóricas. Todas as análises estatísticas foram realizadas usando o software R (versão 4.0.2, Institute of Statistics and Mathematics, Viena, Áustria) e o software SPSS (versão 25.0, IBM Corp., Armonk, NY, EUA). Uma dupla face
P
valor de <0,05, foi considerado estatisticamente significativo.
Na coorte de treinamento, o método de regressão de Cox foi aplicado à análise univariada. O modelo multivariado de regressão de riscos proporcionais de Cox foi então aplicado às variáveis com valores de P não superiores a 0,1, em análise univariada. As covariáveis incluídas no modelo de predição foram selecionadas com base nos resultados da análise de regressão de Cox. Um nomograma prognóstico foi estabelecido para fornecer um modelo preditivo para uso como uma ferramenta de cálculo para prever OS.
Na coorte de validação, o modelo de predição foi verificado por meio da medição da habilidade de discriminação e calibração. Usamos o índice de concordância de Harrell (índice C) para medir a habilidade de discriminação. A validação foi baseada em 1000 reamostragens de bootstrap. A calibração do modelo foi avaliada usando gráficos de calibração, e o efeito da calibração foi avaliado com o teste de Hosmer-Lemeshow. O índice C também foi usado para comparar as habilidades de discriminação do modelo de predição e do sistema de estadiamento TNM tradicional. Uma análise da curva de decisão (DCA) também foi realizada para determinar a utilidade clínica, calculando os benefícios líquidos em diferentes probabilidades de limiar.
19
Resultados
Características de linha de base dos pacientes
Este estudo investigou 328 pacientes com colangiocarcinoma. Em 224 (68,3%) pacientes, o tumor localizava-se em sítio extra-hepático e o restante era colangiocarcinoma intra-hepático. As características clínico-patológicas de base dos pacientes do estudo para o todo (n = 328), treinamento (n = 232) e coortes de validação (n = 96) são mostradas em
tabela 1
. Em toda a coorte, 196 (59,8%) pacientes eram homens e 132 (40,2%) mulheres. Cento e dezessete (35,7%) pacientes tinham 65 anos ou mais quando foram submetidos à cirurgia. Quarenta e seis (14,0%), 78 (54,3%) e 231 (70,4%) pacientes desenvolveram febre, perda de peso e icterícia, respectivamente, com diagnóstico de colangiocarcinoma. Níveis séricos elevados de CA19-9 e CEA foram observados em 254 (77,4%) e 60 (18,3%) pacientes, respectivamente. De acordo com a 7ª edição do AJCC, um (0,3%), 129 (39,3%), 119 (36,3%), 54 (16,5%) e 25 (7,6%) pacientes apresentavam estágios 0, I, II, III e IV doença, respectivamente. A ressecção cirúrgica com intenção curativa foi obtida em 183 (55,8%) pacientes; os demais pacientes não foram submetidos a cirurgia radical. Para 25 (7,6%) pacientes com doença em estágio IV do TNM, a cirurgia paliativa foi realizada para aliviar os sintomas do paciente. O tempo médio de acompanhamento foi de 18,5 meses (variação de 1,0–192,0 meses). Finalmente, 213 pacientes (64,9%) morreram.
tabela 1
Características da linha de base de todos os pacientes
Características clínico-patológicas de acordo com SIRI
Os valores de corte ideais de SIRI, MLR, NLR e PLR gerados usando o software x-tile foram 0,68, 0,24, 3,15 e 106,20, respectivamente. Nas coortes de treinamento e validação, os pacientes foram divididos em grupos de alto SIRI (> 0,68) e baixo SIRI (≤0,68) com base no valor de corte ideal de SIRI.
tabela 1
resume as características de cada paciente. Em comparação com os pacientes no grupo de baixo SIRI nas coortes de treinamento e validação, o grupo de alto SIRI tinha mais pacientes com idade ≥ 65 anos e mais pacientes com maior MLR, maior NLR e níveis séricos elevados de lactato desidrogenase (LDH). Na coorte de treinamento, a taxa de mortalidade aumentou de 42,9% para 72,7% entre os grupos SIRI baixo e alto (p = 0,000), enquanto que na coorte de validação aumentou de 43,5% para 69,6% (p = 0,022). Na coorte de treinamento, mais pacientes no grupo SIRI alto apresentaram níveis elevados de CA19-9 (p = 0,002) e CEA (p = 0,034); menos pacientes foram submetidos à cirurgia radical (56,3% vs 71,4%, p = 0,044) e uma diminuição do tempo mediano de acompanhamento foi observada (16,50 vs 27,00 meses, p = 0,001) em comparação com aqueles no grupo de baixo SIRI; nenhuma diferença significativa foi encontrada na coorte de validação.
Os fatores preditivos do sistema operacional
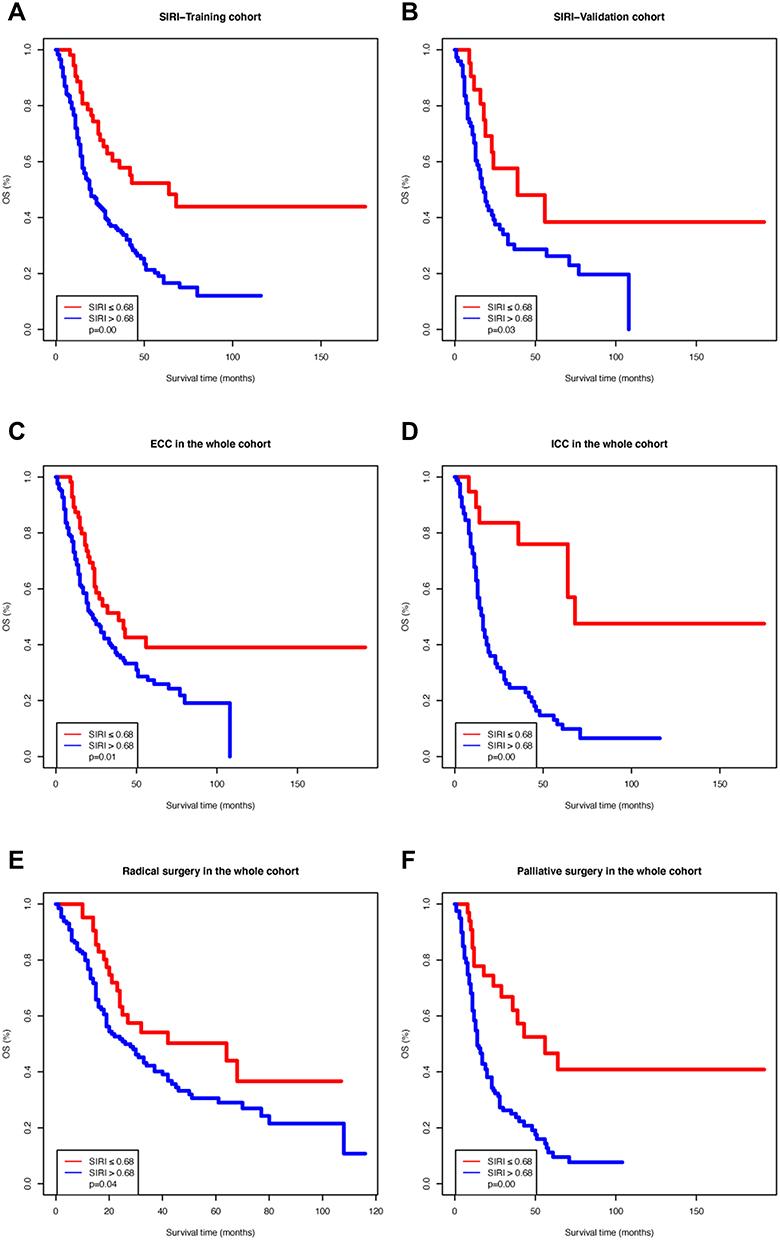
Na coorte de treinamento, as curvas OS Kaplan-Meier com base no SIRI mostraram diferenças significativas, o que foi confirmado pelo teste Log rank (
P
= 0,00;
Figura 1A
) O mesmo resultado foi observado na coorte de validação (
P
= 0,03;
Figura 1B
) Além disso, dividimos toda a coorte com base na localização do tumor (colangiocarcinoma extra-hepático [CEC] ou colangiocarcinoma intra-hepático [ICC]) e tipo de cirurgia (radical ou paliativa). As curvas OS Kaplan-Meier de acordo com o SIRI nas subcoortes acima mencionadas também mostraram diferenças significativas (
Figura 1C
-
F
) Em seguida, realizamos a análise de riscos proporcionais de Cox para OS na coorte de treinamento (
mesa 2
) Na análise univariada, icterícia, CA19-9, γ-glutamil transpeptidase (GGT), fosfatase alcalina (ALP), LDH, albumina (Alb), tamanho máximo do tumor, estágio N, estágio M, cirurgia radical e todos os baseados em inflamação biomarcadores foram estatisticamente associados com OS (p <0,1). Em seguida, a análise multivariada mostrou que icterícia (razão de risco [HR]: 2,0980; intervalo de confiança de 95% [IC]: 1,1567–3,805;
P
= 0,015), SIRI alto (HR: 1,8892; IC 95%: 1,0870–3,2836;
P
= 0,002), PLR (HR: 1,9085; IC 95%: 1,1392–3,1972;
P
= 0,017), GGT (HR: 2,38; IC 95%: 1,1313–5,0072;
P
= 0,022), tamanho máximo do tumor (HR: 2,5509; IC 95%: 1,3096–4,969;
P
= 0,006), estágio N (HR: 1,8034; IC 95%: 1,2337–2,6364;
P
= 0,002), estágio M (HR: 4,3937; IC 95%: 1,1853–16,2874;
P
= 0,027) e cirurgia radical (HR: 0,3675; IC 95%: 0,2558–0,528;
P
= 0,000) foram fatores independentes para prever OS.
mesa 2
Análise univariada e multivariada de riscos proporcionais de Cox para OS na coorte de treinamento
figura 1
Curvas de sobrevida de Kaplan-Meier de diferentes grupos de índice de resposta à inflamação sistêmica (SIRI). (
UMA
) Coorte de treinamento; (
B
) Coorte de validação; (
C
) Pacientes com colangiocarcinoma extra-hepático; (
D
) Pacientes com colangiocarcinoma intra-hepático; (
E
) Pacientes que receberam cirurgia radical; (
F
) Pacientes submetidos à cirurgia paliativa.
O estabelecimento do modelo de previsão para sistema operacional
O modelo prognóstico para OS foi estabelecido a partir de variáveis obtidas na análise multivariada. Os fatores clínico-patológicos prognósticos incluíram oito fatores de risco, incluindo SIRI, PLR, icterícia, GGT, tamanho máximo do tumor, estágio N, estágio M e cirurgia radical. As curvas de características de operação do receptor dependente do tempo (ROC) do modelo de prognóstico, incluindo todos os oito fatores de risco, o modelo de prognóstico excluindo SIRI e PLR e o sistema de estadiamento TNM são mostrados em
Figura 2A
, que mostra que o modelo que integra todos os oito fatores era muito mais confiável na previsão de OS do que o sistema de estadiamento TNM, com áreas de 1, 3 e 5 anos sob as curvas ROC (AUCs) de 0,799, 0,802 e 0,867, respectivamente (AUCs do sistema de estadiamento TNM em 1, 3 e 5 anos: 0,607, 0,593 e 0,602, respectivamente). O modelo que integra todos os fatores também teve AUCs maiores no intervalo de tempo integral do que aqueles para o modelo sem SIRI e PLR. Além disso, as AUCs de SIRI também foram maiores do que aquelas de outros biomarcadores baseados em inflamação, incluindo MLR, NLR e PLR (
Figura 2B
) Em seguida, construímos um nomograma contendo todos esses oito fatores para tornar o modelo prognóstico mais visualizado e prático, conforme mostrado em
Figura 3
. Avaliamos a capacidade preditiva do modelo na coorte de treinamento usando o índice C, que foi 0,737 (95% Cl: 0,683–0,791), indicando uma boa precisão de discriminação do nomograma. O índice C do sistema de estadiamento TNM na coorte de treinamento foi de 0,576 (95% Cl: 0,515–0,637). Além disso, o desempenho do nomograma foi avaliado usando gráficos de calibração de 1, 3 e 5 anos (
Figura 4A
,
C
e
E
) As linhas preditas e de referência tiveram um alto grau de coincidência, indicando um bom desempenho do modelo (teste de Hosmer-Lemeshow,
P
= 0,458, 0,813 e 0,205 para OS de 1, 3 e 5 anos na coorte de treinamento, respectivamente).
Figura 2
Análise de característica de operação do receptor dependente do tempo (ROC) do modelo de prognóstico e sistema de estadiamento TNM (
UMA
) e biomarcadores baseados em inflamação (
B
)
Figura 3
Nomograma prognóstico para predizer a probabilidade de sobrevida global de 1, 3 e 5 anos com base no grupo do índice de resposta à inflamação sistêmica (SIRI), o grupo da proporção de plaquetas para linfócitos (PLR), tamanho máximo do tumor, estágio N, estágio M , cirurgia radical, icterícia e nível de γ-glutamil transpeptidase (GGT) em pacientes com colangiocarcinoma.
Figura 4
Gráfico de calibração de nomograma para prever as probabilidades de sobrevivência global em 1 (
UMA
e
B
), 3 (
C
e
D
), e 5 (
E
e
F
) anos nas coortes de treinamento e validação.
Validação da precisão preditiva do nomograma
Na coorte de validação, a AUC do nomograma para 1, 3 e 5 anos foi 0,822, 0,784 e 0,842, respectivamente (a AUC correspondente do sistema de estadiamento TNM foi 0,566,
0,582 e 0,590, respectivamente). Além disso, o índice C do nomograma para predição de OS (0,738, 95% Cl: 0,679-0,797) foi significativamente maior do que o do sistema de estadiamento TNM (0,523, 95% Cl: 0,465-0,581,P
<0,05). Os gráficos de calibração de 1, 3 e 5 anos (
Figura 4B
,
D
e
F
) para a probabilidade de OS também mostrou um acordo ideal entre a observação real e a previsão usando o modelo de prognóstico (teste de Hosmer-Lemeshow,
P
= 0,322, 0,174 e 0,792 para OS de 1, 3 e 5 anos na coorte de validação, respectivamente). Além disso, DCA para o modelo de prognóstico e sistema de estadiamento TNM (
Figura 5
) mostraram que nosso modelo de prognóstico era mais benéfico do que todos ou nenhum dos esquemas de morte de pacientes se a probabilidade limite de um paciente fosse superior a 30%. Além disso, nesta faixa, nosso modelo proporcionou mais benefícios do que o sistema de estadiamento TNM. Além disso, em comparação com o modelo sem SIRI e PLR, o modelo prognóstico integrando todos os fatores também teve utilidade clínica preferencial, exceto para o DCA de 5 anos na coorte de validação.
Figura 5
Análise da curva de decisão do modelo e sistema de estadiamento TNM para 1- (
UMA
e
B
), 3- (
C
e
D
), e 5- (
E
e
F
) anos de sobrevivência nas coortes de treinamento e validação.
Comparação da precisão preditiva para OS entre o nomograma e o sistema de estadiamento TNM
Com base no modelo de prognóstico desenvolvido neste estudo, dividimos toda a coorte em quatro grupos com riscos diferentes. As curvas OS Kaplan-Meier de acordo com o risco do modelo prognóstico demonstraram diferenças significativas, o que foi confirmado pelo teste de Log rank (
P
= 0,00,
Figura 6A
) Além disso, a classificação prognóstica do modelo foi ainda melhor do que a do sistema de estadiamento TNM (
Figura 6B
), com mais curvas separadas e sem linhas de cruzamento no intervalo de tempo integral. Além disso, em pacientes com CEC ou ICC, nosso modelo também mostrou melhor desempenho de predição prognóstica do que o do sistema de estadiamento TNM (
Figura 6C
-
F
)
Figura 6
Curvas de sobrevivência de Kaplan-Meier do Nomograma e sistema de estadiamento TNM como um todo (
UMA
e
B
), ECC (
C
e
D
), e ICC (
E
e
F
) coortes.
Discussão
Foi relatado que a incidência de colangiocarcinoma aumentou nos últimos anos.
20
,
21
Embora a cirurgia radical continue sendo a única opção curativa, muitos pacientes são diagnosticados em estágio avançado, perdendo a oportunidade de cura. Vários fatores contribuem para o prognóstico ruim atual, com taxas de sobrevida em 5 anos muito baixas e taxas de mortalidade cumulativas aumentando em 39%.
22
,
23
Assim, uma ferramenta precisa para prever o prognóstico de pacientes com colangiocarcinoma é urgentemente necessária no ambiente clínico para que os médicos façam um tratamento individualizado e preciso. Embora o sistema de estadiamento TNM para colangiocarcinoma ainda seja o padrão ouro, limitações como a discriminação insuficiente entre pacientes com o mesmo estágio TNM permanecem não resolvidas.
Weinberg et al acreditam que a inflamação associada ao tumor desempenha um papel importante na carcinogênese e na progressão do tumor.
24
O acúmulo de evidências mostrou que biomarcadores baseados em inflamação sistêmica, incluindo MLR, NLR e PLR, têm papéis prognósticos em vários tipos de tumores. Mais especificamente, no colangiocarcinoma, estudos anteriores descobriram que o NLR pode predizer a sobrevida de pacientes com câncer avançado do trato biliar que recebem quimioterapia paliativa.
10
Em contraste, a PLR é um preditor independente de SG em pacientes com icterícia obstrutiva maligna recorrente.
11
No presente estudo, SIRI, um biomarcador baseado em inflamação, foi um fator prognóstico independente em pacientes com colangiocarcinoma. Um valor SIRI acima de 0,68 indicou pior prognóstico em comparação com um valor SIRI ≤0,68, e também foi correlacionado com outras características clínico-patológicas pobres, como idade avançada, LDH sérica elevada e taxa de mortalidade aumentada. Pesquisas anteriores com foco em outros tipos de tumores sólidos, como câncer gástrico, esofágico e nasofaríngeo, tiveram resultados semelhantes.
13-15
No entanto, o valor de corte ideal de SIRI diferiu entre os estudos, que foi de 1,2 no câncer de esôfago e 1,8 no câncer de pâncreas.
12
,
14
No presente estudo, empregamos 0,68 como valor de corte para estratificar nossos pacientes e validar sua utilidade na coorte de validação; no entanto, se este ponto de corte se aplica a todos os pacientes com colangiocarcinoma, precisa de mais validação interinstitucional externa. Enquanto isso, a análise ROC baseada no tempo mostrou que o SIRI tinha melhor capacidade prognóstica na maioria dos intervalos de tempo em comparação com outros biomarcadores baseados na inflamação, incluindo MLR, NLR e PLR. A análise de regressão multivariada de Cox mostrou que apenas SIRI e PLR foram fatores prognósticos independentes entre todos os biomarcadores baseados em inflamação. Com base nessas descobertas, estabelecemos um modelo de previsão inovador integrando o SIRI, PLR e outros fatores, que demonstrou excelente capacidade preditiva em ambas as coortes de treinamento e validação. Além disso, em comparação com o sistema de estadiamento TNM, o modelo estabelecido no estudo mostrou uma precisão preditiva muito melhor com AUCs muito maiores em 1, 3 e 5 anos, bem como índice C. Além disso, em comparação com o modelo que não integrou o SIRI e o PLR, nosso modelo apresentou AUCs maiores para o intervalo de tempo integral. Nosso modelo de predição também mostrou melhor utilidade clínica, como mostrado por DCA. Além disso, as curvas de Kaplan-Meier da classificação de quatro grupos com base em nosso modelo tiveram melhor discriminação do que o sistema de estadiamento TNM em toda a coorte e nas coortes ECC ou ICC. Portanto, o SIRI apresentou potencial como marcador para predizer o prognóstico de pacientes com colangiocarcinoma. Além disso, o modelo baseado no SIRI e outros fatores teve um valor preditivo excelente para pacientes com colangiocarcinoma após a ressecção cirúrgica. Tanto o SIRI quanto o modelo de previsão baseado nele podem ser aplicados no ambiente clínico para desenvolver regimes terapêuticos mais precisos e personalizados. Até onde sabemos, este é o primeiro estudo a construir um nomograma integrando biomarcadores baseados em inflamação, incluindo SIRI e outros fatores clínico-patológicos, para prever o prognóstico de pacientes com colangiocarcinoma, que mostrou uma melhor capacidade preditiva e utilidade clínica do que aqueles do modelo que não integrou índices baseados em inflamação.
O mecanismo específico pelo qual um SIRI alto prediz resultados ruins em pacientes com colangiocarcinoma ainda não está claro; no entanto, evidências acumuladas indicaram que os linfócitos circulantes desempenham um papel importante na defesa antitumoral, secretando vários tipos de citocinas, como fator de necrose tumoral-alfa (TNF-α) e interferon-gama (IFN-γ) para induzir a apoptose de células cancerosas .
25
,
26
Assim, a diminuição do número e da qualidade dos linfócitos pode resultar no enfraquecimento do sistema imunológico e na defesa do tumor. Além disso, a contagem periférica de monócitos está associada ao nível de macrófagos associados ao tumor, o que contribui para a progressão do tumor e suprime a resposta imune antitumoral.
27
,
28
Da mesma forma, os neutrófilos circulantes podem facilitar a angiogênese tumoral ao produzir fator de crescimento endotelial vascular.
29
Além disso, ao secretar espécies reativas de oxigênio e óxido nítrico, os neutrófilos podem prevenir a ativação de linfócitos T.
30
Portanto, os neutrófilos periféricos podem estar envolvidos no fornecimento de um microambiente tumoral favorável para promover o crescimento, invasão e metástase do tumor.
31
Tomados em conjunto, o SIRI combina todas as três contagens de células imunológicas periféricas em um único índice para lidar com interações complexas. A diminuição dos linfócitos e o aumento dos monócitos ou neutrófilos causarão um SIRI elevado, levando a um pior prognóstico para pacientes com câncer. Finalmente, por sua conveniência, natureza não invasiva, baixo preço e reprodutibilidade, o SIRI pode ser aplicado rotineiramente durante o período de acompanhamento. Tanto o valor pré-operatório de SIRI quanto suas mudanças dinâmicas podem servir como biomarcadores para a avaliação da eficácia da quimiorradioterapia adjuvante, terapia imunológica ou terapia direcionada e para a vigilância de possível recorrência.
O presente estudo tem as seguintes limitações. Em primeiro lugar, esta pesquisa estudou apenas os biomarcadores baseados em inflamação antes da ressecção cirúrgica; no entanto, as mudanças dinâmicas do SIRI e outros fatores durante o acompanhamento também podem se correlacionar com os resultados do paciente, o que requer mais investigação. Em segundo lugar, este foi um estudo retrospectivo unicêntrico, o que pode ter levado a um potencial viés. Embora os resultados tenham sido validados em uma coorte de validação dividida aleatoriamente, uma validação externa adicional é necessária antes que nosso modelo de prognóstico possa ser amplamente utilizado. Terceiro, a inclusão de diferentes tipos de colangiocarcinoma poderia amplificar a heterogeneidade dos pacientes. Embora análises rigorosas de subgrupos tenham sido conduzidas para mostrar que a confiabilidade dos resultados não foi obviamente comprometida por tal heterogeneidade, pesquisas são necessárias para confirmar os resultados em ICC, colangiocarcinoma peri-hilar e colangiocarcinoma distal, respectivamente. Além disso, embora tenhamos dividido aleatoriamente a população geral em uma coorte de treinamento e uma coorte de validação, algumas diferenças nas características da linha de base entre as duas coortes podem causar viés potencial.
Conclusão
Em conclusão, SIRI foi um fator prognóstico independente em pacientes com colangiocarcinoma. Este modelo prognóstico integrando SIRI e outros fatores clínico-patológicos mostrou boa precisão preditiva em prever a probabilidade de sobrevivência dos pacientes e foi melhor do que o sistema de estadiamento TNM. Pode se tornar uma ferramenta confiável para os médicos conduzirem avaliações personalizadas para pacientes com colangiocarcinoma.
Abreviações
SIRI, índice de resposta à inflamação sistêmica; ROC, característica de operação do receptor; TMN, metástase de nódulo tumoral; AJCC, American Joint Committee on Cancer; MLR, proporção de monócitos para linfócitos; NLR, proporção de neutrófilos para linfócitos; PLR, proporção de plaquetas para linfócitos; PUMCH, Peking Union Medical College Hospital; OS, sobrevida geral; CA 19-9, antígeno de carboidrato 19-9; CEA, antígeno carcinoembrionário; Índice C, índice de concordância de Harrell; DCA, análise da curva de decisão; LDH, lactato desidrogenase; ECC, colangiocarcinoma extra-hepático; ICC, colangiocarcinoma intra-hepático; GGT, glutamil transpeptidase (GGT); ALP, fosfatase alcalina; Alb, albumina; HR, razão de risco; IC, intervalo de confiança; AUC, área sob a curva característica de operação do receptor; TNF-α, fator de necrose tumoral-alfa; IFN-γ, interferon-gama.
Aprovação de Ética e Consentimento Informado
Este estudo foi conduzido de acordo com os padrões éticos da Declaração de Helsinque e foi aprovado pelo Comitê de Revisão Institucional do Hospital Peking Union Medical College (Número: S-K1110). consentimento informado por escrito foi obtido de todos os pacientes.
Agradecimentos
Os autores gostariam de agradecer ao Dr. H. Nikki March e ao Dr. Vikas Narang da Editage, pela edição do texto em inglês de um rascunho deste manuscrito.
Financiamento
Este trabalho foi apoiado por doações da Fundação Nacional de Ciências Naturais da China (Número do subsídio: 81972698), Fundo de Inovação da Academia Chinesa de Ciências Médicas (CAMS) para Ciências Médicas (CIFMS) (Número do subsídio: 2017-I2M-4-002) e Fundação Chen Xiao-Ping para o Desenvolvimento da Ciência e Tecnologia da Província de Hubei (Número da concessão: CXPJJH11900001-2019215).
Divulgação
Os autores declaram não haver conflito de interesses.
Referências
1
Tyson GL, El-Serag HB. Fatores de risco para colangiocarcinoma.
Hepatologia
. 2011; 54: 173–184. doi: 10.1002 / hep.24351
2
Rizvi S, Gores GJ. Patogênese, diagnóstico e manejo do colangiocarcinoma.
Gastroenterologia
. 2013; 145: 1215–1229.
3
Khan SA, Emadossadaty S, Ladep NG, et al. Tendências crescentes no colangiocarcinoma: o sistema de classificação da CID está nos enganando?
J Hepatol
. 2012; 56: 848–854. doi: 10.1016 / j.jhep.2011.11.015
4
Raoof M, Singh G. Tendências crescentes na incidência e mortalidade de colangiocarcinoma intra-hepático: chegando à causa raiz.
Hepatobiliary Surg Nutr
. 2019; 8: 301–303. doi: 10.21037 / hbsn.2019.01.15
5
Jarnagin WR, Fong Y, DeMatteo RP, et al. Estadiamento, ressecabilidade e resultado em 225 pacientes com colangiocarcinoma hilar.
Ann Surg
. 2001; 234: 507. doi: 10.1097 / 00000658-200110000-00010
6
de Jong MC, Marques H, Clary BM, et al. O impacto da ressecção da veia porta nos resultados para colangiocarcinoma hilar: uma análise multi-institucional de 305 casos.
Câncer
. 2012; 118: 4737–4747. doi: 10.1002 / cncr.27492
7
Rizvi S, Khan SA, Hallemeier CL, Kelley RK, Gores GJ. Colangiocarcinoma - conceitos em evolução e estratégias terapêuticas.
Nat Rev Clin Oncol
. 2018; 15: 95–111. doi: 10.1038 / nrclinonc.2017.157
8
McLean L, Patel T. Variações raciais e étnicas na epidemiologia do colangiocarcinoma intra-hepático nos Estados Unidos.
Fígado Int
. 2006; 26: 1047–1053.
9
Diakos CI, Charles KA, McMillan DC, Clarke SJ. Inflamação relacionada ao câncer e eficácia do tratamento.
Lancet Oncol
. 2014; 15: e493–503. doi: 10.1016 / S470-2045 (14) 70263-3
10
Ha H, Nam AR, Bang JH, et al. Soluble programmed death-ligand 1 (sPDL1) and neutrophil-to-lymphocyte ratio (NLR) predicts survival in advanced biliary tract cancer patients treated with palliative chemotherapy.
Oncotarget
. 2016;7:76604–76612. doi:10.18632/oncotarget.2810
11.
Jin H, Pang Q, Liu H, et al. Prognostic value of inflammation-based markers in patients with recurrent malignant obstructive jaundice treated by reimplantation of biliary metal stents: a retrospective observational study.
Medicine
. 2017;96:e5895. doi:10.1097/MD.0000000000005895
12.
Qi Q, Zhuang L, Shen Y, et al. A novel systemic inflammation response index (SIRI) for predicting the survival of patients with pancreatic cancer after chemotherapy.
Cancer
. 2016;122:2158–2167. doi:10.1002/cncr.30057
13.
Li S, Lan X, Gao H, et al. Systemic Inflammation Response Index (SIRI), cancer stem cells and survival of localised gastric adenocarcinoma after curative resection.
J Cancer Res Clin Oncol
. 2017;143:2455–2468. doi:10.1007/s00432-017-2506-3
14.
Geng Y, Zhu D, Wu C, et al. A novel systemic inflammation response index (SIRI) for predicting postoperative survival of patients with esophageal squamous cell carcinoma.
Int Immunopharmacol
. 2018;65:503–510. doi:10.1016/j.intimp.2018.10.002
15.
Chen Y, Jiang W, Xi D, et al. Development and validation of nomogram based on SIRI for predicting the clinical outcome in patients with nasopharyngeal carcinomas.
J Investig Med
. 2019;67:691–698. doi:10.1136/jim-2018-000801
16.
World Medical Association. Declaration of Helsinki: ethical principles for medical research involving human subjects.
J Am Coll Dent
. 2014;81:14–18.
17.
Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM.
Ann Surg Oncol
. 2010;17:1471–1474.
18.
Camp RL, Dolled-Filhart M, Rimm DL. X-tile: a new bio-informatics tool for biomarker assessment and outcome-based cut-point optimization.
Clin Cancer Res
. 2004;10:7252–7259. doi:10.1158/078-0432.CCR-04-713
19.
Vickers AJ, Elkin EB. Decision curve analysis: a novel method for evaluating prediction models.
Med Decis Making
. 2006;26:565–574. doi:10.1177/0272989X06295361
20.
Saha SK, Zhu AX, Fuchs CS, Brooks GA. Forty-Year Trends in Cholangiocarcinoma Incidence in the US: intrahepatic Disease on the Rise.
Oncologist
. 2016;21:594. doi:10.1634/theoncologist.2015-0446
21.
Yang JD, Kim B, Sanderson SO, et al. Biliary tract cancers in Olmsted County, Minnesota, 1976–2008.
Am J Gastroenterol
. 2012;107:1256–1262.
22.
Razumilava N, Gores GJ. Cholangiocarcinoma.
Lancet
. 2014;383:2168–2179. doi:10.1016/S0140-6736(13)61903-0
23.
Antwi SO, Patel T. Increasing mortality of intrahepatic cholangiocarcinoma in the US: are gender-specific risk factors important?
Hepatobiliary Surg Nutr
. 2019;8:635. doi:10.21037/hbsn.2019.10.10
24.
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation.
Cell
. 2011;144:646–674. doi:10.1016/j.cell.2011.02.013
25.
Ferrone C, Dranoff G. Dual roles for immunity in gastrointestinal cancers.
J Clin Oncol
. 2010;28:4045–4051. doi:10.1200/JCO.2010.27.9992
26.
Rosenberg SA. Progress in human tumour immunology and immunotherapy.
Nature
. 2001;411:380–384. doi:10.1038/35077246
27.
Franklin RA, Liao W, Sarkar A, et al. The cellular and molecular origin of tumor-associated macrophages.
Science
. 2014;344:921–925. doi:10.1126/science.1252510
28.
Shibutani M, Maeda K, Nagahara H, et al. The peripheral monocyte count is associated with the density of tumor-associated macrophages in the tumor microenvironment of colorectal cancer: a retrospective study.
BMC Cancer
. 2017;17:404. doi:10.1186/s12885-017-3395-1
29.
Kusumanto YH, Dam WA, Hospers GA, Meijer C, Mulder NH. Platelets and granulocytes, in particular the neutrophils, form important compartments for circulating vascular endothelial growth factor.
Angiogenesis
. 2003;6:283–287. doi:10.1023/B:AGEN.0000029415.62384.ba
30.
Müller I, Munder M, Kropf P, Hänsch GM. Polymorphonuclear neutrophils and T lymphocytes: strange bedfellows or brothers in arms?
Trends Immunol
. 2009;30:522. doi:10.1016/j.it.2009.07.007
31.
Liu S, Li N, Yu X, et al. Expression of intercellular adhesion molecule 1 by hepatocellular carcinoma stem cells and circulating tumor cells.
Gastroenterology
. 2013;144:1031–41.e10.
This work is published and licensed by Dove Medical Press Limited. The full terms of this license are available at
https://www.dovepress.com/terms.php
and incorporate the
Creative Commons Attribution - Non Commercial (unported, v3.0) License
.By accessing the work you hereby accept the Terms. Non-commercial uses of the work are permitted without any further permission from Dove Medical Press Limited, provided the work is properly attributed. For permission for commercial use of this work, please see paragraphs 4.2 and 5 of
our Terms
.
Baixar Artigo
[PDF]




